1.10a 空気中の密度が0.987 bar, 27 ℃で1.146kgm-3 であることから、窒素と酸素のモル分率と分圧を計算せよ。ただし、(a)空気がこの2種類の気体だけからできていると仮定、(b)空気には1.0モルパーセントのArも含まれていると仮定せよ。
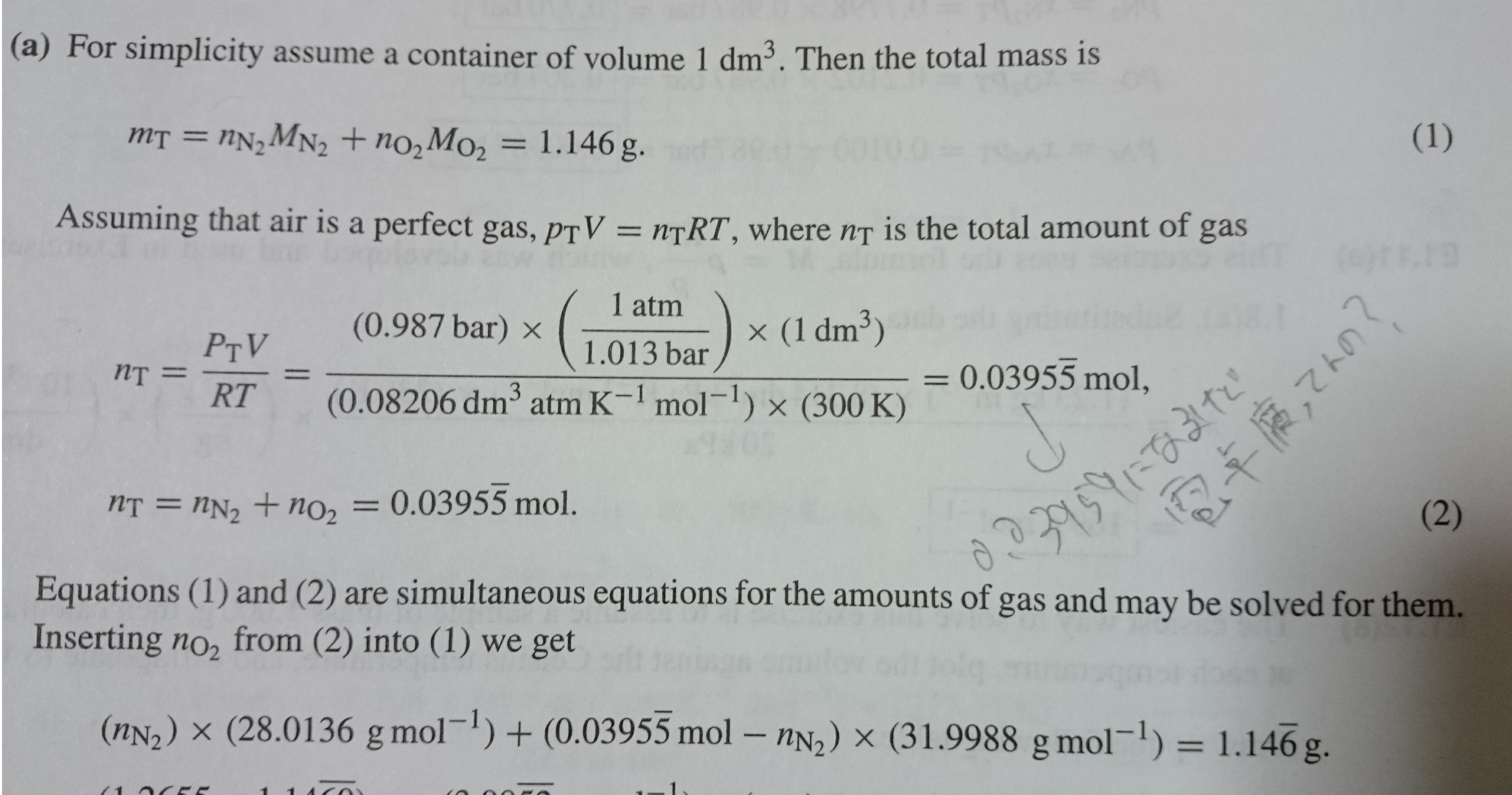
訂正
(nair/V) =(RT/P)
= (0.987・105 / 300 ・8.314 = 39.571) = 39.57 [ mol・m-3 ]
(nO2/V )・MO2 + (nN2/V)・MN2 = (nair/V) = 1.146 [ kg・m-3 ] //設問より
(nair/V) - (nO2/V) = (nN2/V) //2種の気体だけからできている過程より
(nO2/V ) ・(MO2 - MN2) + (nair/V)・MN2 = 1.146 [ kg・m-3 ]
1.146 - (nair/V)・MN2 = 1.146 - 39.57・28.0136・10-3 = 0.03750 [ kg・m-3 ]
(MO2 - MN2) = (31.9988 - 28.0136) ・10-3 = 0.003985 [ kg・mol-1 ]
(nO2/V ) = (0.03750 [ kg・m-3 ] / 0.003985 [ kg・mol-1 ]) = 9.410 [ mol・m-3 ]
(nN2/V) = (nair/V) - (nO2/V) = 39.57 [ mol・m-3 ] - 9.410 [ mol・m-3 ] = 30.16 [ mol・m-3 ]
XO2 = (nO2 / nO2 + nN2) = (9.410 / 9.410 + 30.16) = 0.2378
XN2 = 1 - XO2 = 0.7622
(b)
XAr = 0.01
(nair/V) ・0.01 = 3.957
XO2 = 0.2374・(99/100) =0.2350
XN2 = 0.7622・(99/100) = 0.7546

コメント
最新を表示する
NG表示方式
NGID一覧